Von-Willebrand-Jürgens-Syndrom
Pädiatrie
Steckbrief
Das Von-Willebrand-Jürgens-Syndrom ist die häufigste angeborene hämorrhagische Diathese, dabei ist die Aktivität des Faktor-VIII-Trägerproteins (Von-Willebrand-Faktor, vWF) verringert. Die Erkrankung ist genetisch bedingt, erworbene Formen sind sehr selten. Beim Typ 1 liegt ein quantitativer Mangel an vWF vor, beim Typ 2 bestehen qualitative Defekte, Typ 3 ist die schwerste Verlaufsform. Klinisch kann die Erkrankung sehr unterschiedlich verlaufen (von symptomlos bis zu schweren Blutungen). Diagnostisch ist oft die Anamnese wegweisend (familiäre Blutungsneigung), im Labor wird der vWF bestimmt. Therapeutisch werden je nach Typ Desmopressin (DDAVP = 1-Desamino-8-D-Arginin-Vasopressin), vWF-Konzentrat und Hämostyptika angewandt.
Synonyme
- Angiohämophilie
- Von-Willebrand-Krankheit
- von Willebrand diesease
Keywords
- (spontane) Hämorrhagien
- (spontane) Blutungen
- Hämatome
- Von-Willebrand-Faktor
- Faktor VIII
Definition
Das Von-Willebrand-Jürgens-Syndrom (vWS) ist eine autosomal-dominant oder autosomal-rezessiv vererbte Blutungskrankheit mit Mangel oder gestörter Funktion des Von-Willebrand-Faktors (vWF bildet Komplex mit Faktor VIII und vermittelt die Thrombozytenadhäsion bei Gefäßwandverletzung). Bei Mangel an vWF ist die Thrombozytenadhäsion/-aggregation gestört.
Epidemiologie
Häufigkeit
- Die Prävalenz wird auf 800/100000 Menschen geschätzt.
- Bei nur ca. 12,5/100000 der Betroffenen entwickeln sich allerdings signifikante Symptome.
Altersgipfel
- Manifestation in jedem Alter, v.a. abhängig vom Typ
- Bei Mädchen wir die Diagnose häufig nach der Menarche (durch verstärkte oder verlängerte Regelblutung) gestellt.
Geschlechtsverteilung
- Männliches und weibliches Geschlecht sind gleich häufig betroffen.
Prädisponierende Faktoren
- familiäre Häufung
Ätiologie und Pathogenese
- Das Gen für den vWF befindet sich auf dem Chromosom 12 an Genlokus 12p13.3, bei Von-Willebrand-Syndrom liegt hier eine Mutation vor.
- Die Vererbung erfolgt für die verschiedenen Typen 1–3 unterschiedlich.
- Mangel und/oder gestörte Funktion des vWF führt bei Gefäßverletzung zu gestörter Thrombozytenadhäsion und -aggregation und damit zu vermehrter Blutungsneigung.
Klassifikation und Risikostratifizierung
- Typ 1 (60–80% der Patienten):
- autosomal-dominant mit variabler Penetranz
- verminderte Bildung des vWF
- Typ 2 (15–20% der Patienten): qualitativer Mangel des vWF; 5 Untertypen
- Typ 2A autosomal-dominant
- Typ 2B autosomal-dominant
- Typ 2C autosomal-rezessiv
- Typ 2M autosomal-dominant
- Typ 2N autosomal-dominant
- Typ 3 (5%) autosomal-rezessiv, schwerste Form (keine Bildung des vWF)
- Es kommt zur Störung der primären (thrombozytären) Hämostase durch die gestörte Thrombozytenadhäsion und -aggregation und zur Störung der sekundären (plasmatischen) Hämostase.
- Letzteres ist bedingt durch die Funktion des vWF als Trägerprotein des Faktors VIII mit fehlender Ausbildung von Faktors VIII und dem nachgeschalteten Faktor X.
- Dadurch kommt es zu einer der Hämophilie A ähnlichen Symptomatik.
Symptomatik
- Postpartal ist der vWF noch hoch, erreicht ab dem 6. Lebensmonat Erwachsenwerte.
- Häufig bleibt der Mangel an vWF asymptomatisch und undiagnostiziert.
- Bei symptomatischer Erkrankung äußert sich diese mit vermehrten und verlängerten Blutungen nach Traumen und Operationen, tlw. aber auch mit Spontanblutungen (Epistaxis, Hämatome, selten Hämarthros u.a.).
- bei Mädchen/weiblichen Jugendlichen häufig verlängerte und vermehrte Monatsblutung (Menorrhagie und Metrorrhagie), häufig mit positiver Familienanamnese (Mutter)
- vWF hat Einfluss auf endotheliale Zellproliferation; bei Mangel Ausbildung von Angiodysplasien v.a. im GI-Trakt mit Blutungen
- Komplikationen:
- Magen-Darm-Blutung
- Hämaturie
- selten meningeale/intrazerebrale und andere Blutungen bis zur Unstillbarkeit
Diagnostik
Diagnostisches Vorgehen
- ausführliche Anamnese
- körperliche Untersuchung
- Labor
- ggf. mikrobiologische, bildgebende, instrumentelle und histologische Diagnostik
Anamnese
- Eine ausführliche längsschnittliche Krankheitsanamnese hinsichtlich des depressiven Verlaufs einschließlich potenzieller (hypo)manischer Episoden ist Grundlage des diagnostischen Prozesses. Bei Vorliegen nichtchronischer depressiver Episoden ist die ausführliche Exploration des Befindens vor und nach der akuten depressiven Episode entscheidend, um dysthyme Phasen nicht zu übersehen. Zur angemessenen Diagnostik wird die Erstellung einer Lebenslinie empfohlen (Abb. 22.1).
| Merke Das wichtigste „diagnostische Tool“ der präoperativen Gerinnungsdiagnostik ist die sorgfältige Anamnese! |
Anamnese
- Fragen nach Blutungsneigung (auch in der Familie) unter Verwendung standardisierter Fragebögen
Körperliche Untersuchung
- (großflächige) Hämatome, auch an ungewöhnlichen Stellen
- (spontane) Epistaxis
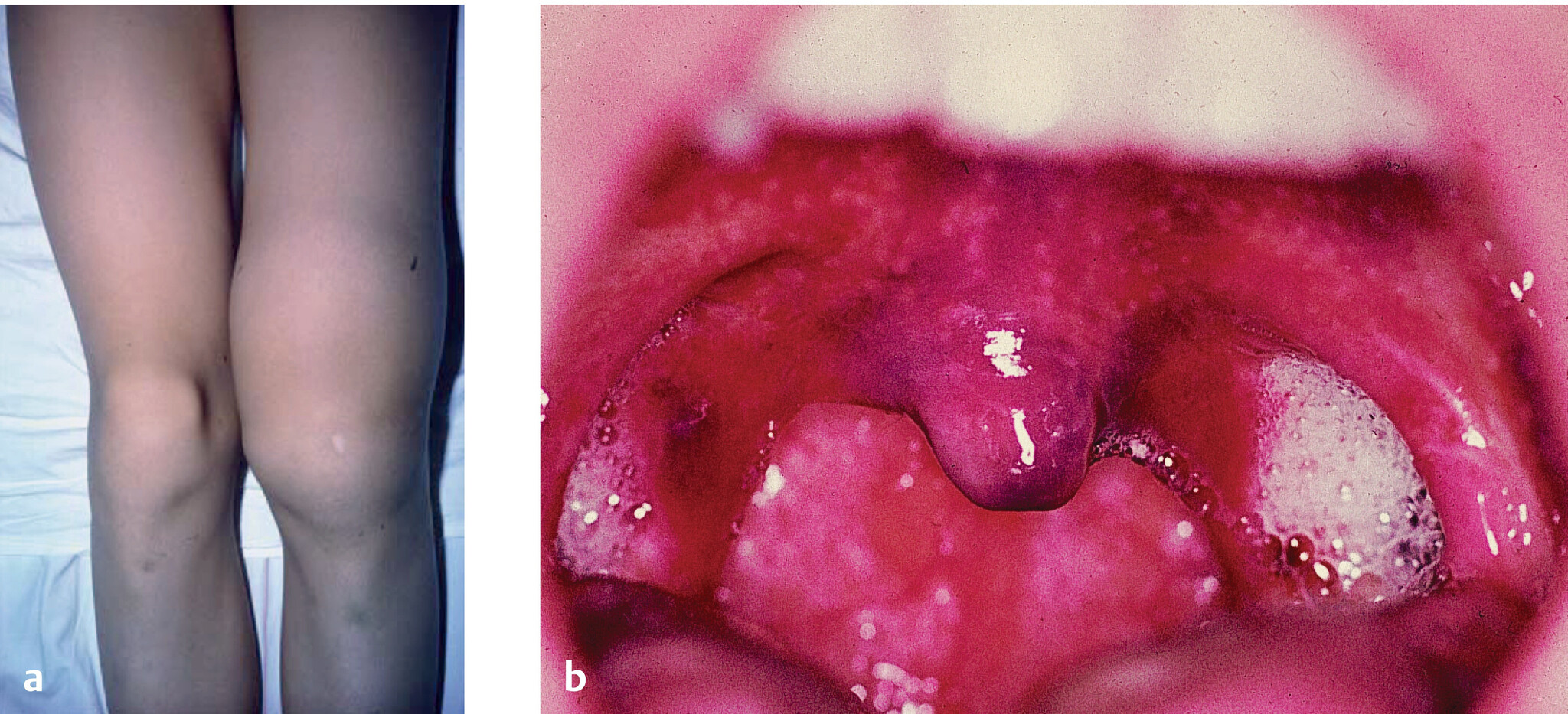
- geschwollene Gelenke und/oder Muskeln bei Einblutungen (Abb. 509.1)
- verlängerte Blutungen auch nach kleineren Eingriffen, i.m. Injektionen
- Wundheilungsstörungen
- evtl. neurologische Symptome bei intrazerebralen Blutungen (selten)
- evtl. Hämoptysen/Hämoptoe
Abb. 509.1 Blutungen beim Von-Willebrand-Syndrom.
a Gelenkblutung.
b Schleimhautblutung.
(Quelle: Muntean E. Von-Willebrand-Jürgens-Syndrom. In: Gortner L, Meyer S, Hrsg. Duale Reihe Pädiatrie. 5., vollständig überarbeitete Aufl. Stuttgart: Thieme; 2018.)
Labor
- BB (Blutbild), PTT (partielle Thromboplastinzeit), PZ (Prothrombinzeit), Faktorenbestimmung, Blutungszeit
- bei leichten Formen durch Globaltests (v.a. PTT ↑) nicht mit Sicherheit auszuschließen, PTT bei 30–50% normal
- Thrombozytenzahl normal (nur bei Typ 2B ↓)
- Blutungszeit bzw. PFA-200 (PFA = Platelet Function Analyzer) oft (aber nicht immer!) verlängert
- spezifische Diagnostik: Faktor VIII ↓, Willebrand-Faktor bzw. vWF-Antigen ↓, Ristocetin-Kofaktor ↓
- Thrombozytenadhäsion abgeschwächt
| Merke Unter gewissen Umständen (z.B. Kontrazeptiva, Schwangerschaft, Infektionen, Stress) kommt es häufig zur Besserung der Klinik und der Laborwerte, was die Diagnosestellung erschwert. Träger der Blutgruppe 0 haben physiologischerweise einen um 20–30% niedrigeren vWF. |
Mikrobiologie
- evtl. zum differenzialdiagnostischen Ausschluss einer (post-)infektiösen Ursache für Hämorrhagien
Elektrophorese
- zur Feststellung eines qualitativen vWF-Mangels bzw. der Polymerbildung von vFW
- Anmerkung: Die Synthese des wirksamen vWF erfolgt über monomere Vorstufen (Prä-Pro-vWF), diese Monomere werden zu Polymeren zusammengefügt und ergeben dadurch das wirksame Protein.
RIPA-Test („Ristocetin-induced platelet aggregation“)
- Bestimmung der Thrombozytenaggregation; diese ist bei vWF-Mangel gestört
Bildgebende Diagnostik
Sonografie
- bei Verdacht auf Blutungen (Muskel, Gelenke, innere Organe)
Instrumentelle Diagnostik
Ösophago-Gastro-Duodenoskopie (ÖGD)
- bei Verdacht auf gastrointestinale Blutungen
Koloskopie
- bei Verdacht auf gastrointestinale Blutungen
Bronchoskopie
- bei Verdacht auf gastrointestinale Blutungen
Histologie, Zytologie und klinische Pathologie
Knochenmarkdiagnostik
- ggf. bei Thrombopenie (selten) zum Ausschluss einer myeloischen Genese
Molekulargenetische Diagnostik
- für Diagnosestellung nicht wesentlich
- evtl. hilfreich für Beurteilung einer eventuellen Bildung von Alloantikörpern gegen Faktoren VIII und X (Hemmkörper); diese können Probleme bei der Faktorensubstitution bedingen
- Anmerkung: vWF-Gen ist sehr variantenreich → Abgrenzung eines vWS Typ 1 von niedrig-normalen vWF-Spiegeln oft schwierig bis unmöglich
Differenzialdiagnosen
|
meist 1–2 Wochen nach Virusinfekt der oberen Luftwege, Röteln, Varizellen, EBV, CMV, u.a. (selbstlimitierend) |
|
|
chronische ITP (Morbus Werlhof) |
verläuft in ca. 10% der Fälle mit bis zu jahrelangen Schüben (oft selbstlimitierend) |
|
Faktor VIII ↓, X-chromosomal-rezessiv, PZ normal, PTT ↑, häufigste Form, Faktorensubstitution bei Bedarf |
|
|
Faktor IX ↓, X-chromosomal-rezessiv, PZ normal, PTT ↑, Faktorensubstitution bei Bedarf |
|
|
Faktor XI ↓, autosomal-rezessiv, PZ normal, PTT ↑, Blutungsneigung korreliert wenig mit Faktor-XI-Spiegel, kein Faktorenkonzentrat vorhanden, bei Bedarf Fresh Frozen Plasma |
|
|
autosomal-rezessiv, selten, unterschiedliche Ausprägung, PZ ↑, Manifestation in jedem Alter Therapie: Faktor-X-Substitution, Prothrombin, Fresh Frozen Plasma |
|
|
autosomal-rezessiv, Faktor V ↓, PTZ ↑, PTT ↑, unterschiedliche Ausprägung, Manifestation in jedem Alter möglich |
|
|
autosomal-rezessiv; Riesen-Thrombozyten, defekte Aggregation (Ristocetin-Test neg.), Thrombopenie verlängerte Blutungszeit, PZ, PTT, vWS normal |
|
|
bei Amyloidose, Vitamin-K-Mangel (therapeutische Hemmung, Lebererkrankungen), L-Asparaginasetherapie, Verbrauchskoagulopathie |
|
|
verminderte vWF-Synthese/gestörter Abbau Ursachen: Erkrankungen des Knochenmarks (myeloproliferatives Syndrom), lymphoproliverative Erkrankungen, kardiale Erkrankungen, Autoimmunerkrankungen, Kollagenosen (systemischer Lupus erythematodes), Antikörper gegen Von-Willebrand-Faktor), Malignome (multiples Myelom), Medikamente (Valproat, Ciprofloxacin u.a.) |
|
|
Morbus Rendu-Osler: angeborene Gefäßwandschwäche mit Verlust der elastischen Fasern Von-Hippel-Lindau-Syndrom: autosomal-dominant mit multiplen Angiomen: Netzhaut, Kleinhirn, Rückenmark, Niere, Nebenniere, Bauchspeicheldrüse Ehlers-Danlos-Syndrom: Kollagenstörung mit Überdehnbarkeit von Muskeln, Gelenken, Bändern, Gefäßen, inneren Organen; Blutgefäßen (Aneurysmen, Aortendissektion) erworben: Vaskulitis (Pupura Schönlein-Henoch, s. oben), Vitamin-C-Mangel (Skorbut) |
|
|
CMV = Zytomegalievirus, EBV = Epstein-Barr-Virus, ITP = akute postinfektiöse Thrombozytopenie, SLE = systemischer Lupus erythematodes. |
|
Therapie
Therapeutisches Vorgehen
- symptomatisch (Blutstillung, Observanz, Fibrinolysehemmer)
- medikamentös
- bei lebensbedrohlichen, andernfalls nicht beherrschbaren Blutungen operative Blutstillung
Pharmakotherapie
- für milden Typ 1:
- bei Blutung bzw. als Operationsvorbereitung DDAVP (1-Desamino-8-D-Arginin-Vasopressin = Vasopressin-Analogon/Desmopressin) 0,3–0,4μg/kg subkutan oder intravenös über 30min bzw. 2–4µg/kg intranasal (vorher Testung des individuellen Ansprechens), wirkt 4–6h
- für gleiche Wirkung nächste Gabe nicht vor 48h
- adjuvante Gabe von Antifibrinolytika (Epsilonaminocapronsäure und Tranexamsäure (Bsp. Cyclokapron)) können zur Behandlung und Vorbeugung von Blutungen gegeben werden.
- Tranexamsäure:
- peroral
- 15–25(50)mg/kg am Vorabend des Eingriffs bzw. am Morgen des Eingriffs
- Erhaltungsdosis: 15–25mg/kg 3–4×tgl.
- intravenös:
- 10–15mg/kg am Tag des Eingriffs
- Erhaltungsdosis: 10–15mg/kg 3×tgl.
- Tranexamsäure:
- bei schweren Formen bzw. Typ 2 und 3: vWF-Konzentrat 30–50 IE/kg alle 12h
| Merke Die blutungsstillende Wirkung beruht auf einer Freisetzung von Von-Willebrand-Faktor (vWF) aus Endothelzellen und verbessert die Wirkung von Faktor VIII. Bei wiederholter Gabe erschöpft sich die Wirkung (Tachyphylaxie), da weiterer vWF vorübergehend nicht mehr mobilisierbar ist. |
|
Hinweis DDAVP-Gabe (z.B. Octostim) führt zur endogenen Freisetzung von vWF; diese erschöpft sich jedoch nach 3–4 Einzelgaben. Bei Typ 2B und Typ 3 ist Desmopressin unwirksam, bei Typ 2B kann es eine Thrombopenie verstärken. Alternativ werden Faktorenkonzentrate verabreicht. Bei schweren Blutungen mit Volumenersatz soll Desmopressin aufgrund der DDAVP-bedingten Flüssigkeitsretention sehr zurückhaltend verabreicht werden. Möglichst keine Desmopressingabe bei Kindern <2 Jahren, Anfallsleiden, Nierenerkrankungen, (Schwangere)! Häufige Gabe kann durch Flüssigkeitsretention zu Hyponatriämie führen („Verdünnungseffekt“). |
Nachsorge
- Patienteninformation und „Ausweis“/Hämophiliepass (mitführen!)
- sorgfältige Planung operativer Eingriffe
- Risikovermeidung (keine Risiko- und Kampfsportarten)
- Berücksichtigung der Vererbbarkeit (Kinder)
Verlauf und Prognose
- Heilung nicht möglich
- bei adäquater Vorsorge/Prävention normale Lebenserwartung
Literatur
Quellenangaben
- Starz I, Kerbl R. Von-Willebrand-Jürgens-Syndrom. In: Kerbl R, Reiter K, Wessel L, Hrsg. Referenz Pädiatrie. Version 1.0. Stuttgart: Thieme; 2024.
eRef-Link: https://eref.thieme.de/1Z62SWSR