Angeborene Gerinnungsstörungen in der Schwangerschaft: Von-Willebrand-Syndrom
Geburtshilfe und Perinatalmedizin
Steckbrief
Das Von-Willebrand-Syndrom ist die häufigste angeborene hämorrhagische Diathese und bedingt durch einen quantitativen und/oder qualitativen Defekt des Von-Willebrand-Faktors. Die Blutungsneigung hängt vor allem vom Subtyp der Erkrankung und von den Restaktivitäten der Gerinnungsfaktoren ab. Diagnostisch wegweisend sind eine positive Familienanamnese, die Blutungsanamnese sowie die Bestimmung der aktivierten partiellen Thromboplastinzeit, des Von-Willebrand-Faktor-Antigens, der Von-Willebrand-Faktor-Aktivität und des Faktors VIII. Es besteht ein erhöhtes Risiko besonders für postpartale Blutungen, das sub partu bei Typ 1 am geringsten ist. In Abhängigkeit vom Typ kommen zur Behandlung Desmopressin und Faktorenkonzentrate zum Einsatz, Tranexamsäure zur Prävention der postpartalen Blutung.
Aktuelles
Im Jahr 2021 wurden die gemeinsamen Leitlinien der American Society of Hematology, der International Society of Thrombosis and Haemostasis, der National Hemophilia Foudation und der World Federation of Hemophilia zur Diagnostik und Behandlung des Von-Willebrand Syndroms publiziert.
Synonyme
- Von-Willebrand-Erkrankung
- Von-Willebrand-Jürgens-Syndrom
Keywords
- Angeborenes Von-Willebrand-Syndrom
- Subtypen 1, 2(A,B,N,M) und 3
- erworbenes Von-Willebrand-Syndrom
- Familienanamnese
- Blutungsanamnese
- Bleeding-Score der International Society on Thrombosis and Haemostasis
- Menorrhagie
- Von-Willebrand-Faktor-Antigen
- Von-Willebrand-Faktor-Aktivität
- Faktor-VIII-Aktivität
- Desmopressin
- Desmopressintest
- Von-Willebrand-Faktor/Faktor-VIII-Konzentrate
- postpartale Blutungen
- Tranexamsäure
Definition
- Das Von-Willebrand-Syndrom ist die häufigste vorwiegend autosomal-dominant (seltener -rezessiv) vererbte hämorrhagische Diathese.
- Die verschiedenen Subtypen entsprechen einem quantitativen und/oder qualitativen Defekt des Von-Willebrand-Faktors mit Blutungsneigung unterschiedlichen Schweregrads.
Epidemiologie
Häufigkeit
- Gesamt: in der Bevölkerung 0,01–1,30%
- Typ 3: 1:1 000 000 in der Bevölkerung
- schwere Verlaufsformen mit klinisch relevanten Blutungskomplikationen: 1:3000–1:10 000 aller Betroffenen
- erworbene Form: selten; 0,3:100 000 Männer und Frauen
Altersgipfel
-
Nicht bekannt
Geschlechtsverteilung
-
Männer zu Frauen im Verhältnis 1:1 betroffen
Prädisponierende Faktoren
-
Positive Familienanamnese: autosomal-dominant oder -rezessiv vererbbar
Ätiologie und Pathogenese
- Der Von-Willebrand-Faktor, dessen Gen auf dem Chromosom XII lokalisiert ist, wird in Endothelzellen und Megakariozyten synthetisiert und hat eine multimere Struktur. Durch Polymerisation beträgt seine Größe 40 000 kDA. Nach Sekretion aus den Endothelzellen in die Zirkulation erfolgt eine Abspaltung supranormaler Multimere durch die den Von-Willebrand-Faktor spaltende Protease (ADAMTS XIII).
- Funktionen des Von-Willebrand-Faktors:
- Er vermittelt die Interaktion mit Thrombozyten durch Bindung an deren GPIb-Rezeptor.
- Er bindet an freiliegende Kollagenstrukturen der defekten Gefäßwand.
- Er ist Trägerprotein für Faktor VIII:C im Plasma. Dadurch wird der vorzeitige Abbau von Faktor VIII:C vermieden.
- Das Von-Willebrand-Syndrom ist eine Störung der primären (zellulären) Hämostase sowie der sekundären (plasmatischen) Hämostase. Die Gerinnungsstörung wird durch eine quantitative Verminderung (bis hin zum völligen Fehlen) oder durch einen qualitativen Defekt des Von-Willebrand-Faktors verursacht.
- Durch den Konzentrationsanstieg der Gerinnungsfaktoren normalisiert sich beim milden Typ 1 bis zur Geburt die Gerinnung, das Blutungsrisiko ist daher gering.
- Die Prävalenz des erworbenen Von-Willebrand-Syndroms ist nicht bekannt. Es tritt meist bei älteren Patientinnen mit onkologischen oder kardiovaskulären Begleiterkrankungen auf und wird durch unterschiedliche Pathomechanismen verursacht. Abhängig von der Grunderkrankung ist der Von-Willebrand-Faktor vermindert oder qualitativ verändert:
- z.B. bei lymphatischen oder myeloproliferativen Erkrankungen, Neoplasien und Autoimmunerkrankungen,
- bei angeborenen Herz- und Gefäßanomalien, schwerer Aortensklerose, Endokarditis,
- bei Hypothyreose, Urämie oder
- bei medikamentöser Therapie mit Ciprofloxacin, Valproat.
| Merke In der normalen Schwangerschaft kommt es ab dem frühen 1. Trimenon beim Typ 1 zu einem progredienten, 2- bis 3-fachen Anstieg der Von-Willebrand-Faktor-Konzentration und der Faktor-VIII-Aktivität mit maximalen Spiegeln zum Zeitpunkt der Geburt. Diese erhöhten Spiegel persistieren bis zu 48 h post partum und fallen dann innerhalb von 3 Wochen auf Basalwerte vor der Schwangerschaft ab. Beim Typ 2 und 3 ist kein regelhafter Anstieg zu erwarten. |
Klassifikation und Risikostratifizierung
- Einteilung (Tab. 12.22):
- Typ 1 (54–80%):
- quantitative Verminderung des Von-Willebrand-Faktors (unter 30[–50] IU/dl) bei erhaltener Funktionsfähigkeit
- autosomal-dominant vererbt
- variable Penetranz
- Typ 2 (ca. 20%):
- struktureller und funktioneller Defekt des Von-Willebrand-Faktors
- Von-Willebrand-Faktor-Aktivität: Von-Willebrand-Faktor-Antigen-Ratio kleiner als 0,6
- autosomal-dominant vererbt
- mittleres Blutungsrisiko für Mutter und Kind
- Typ 2A:
- Fehlen der großen und intermediären Von-Willebrand-Faktor-Multimere
- verminderte Von-Willebrand-Faktor-abhängige Thrombozytenadhäsion bei normalen oder nur gering verminderten Von-Willebrand-Faktor-Spiegeln
- Typ 2B:
- Fehlen der großen Von-Willebrand-Faktor-Multimere
- Thrombozytopenie durch verstärkte Bindung des Von-Willebrand-Faktors an GP1b der Thrombozyten
- Typ 2M:
- qualitativer Defekt infolge Genmutation des Von-Willebrand-Faktors mit verminderter Bindung des Von-Willebrand-Faktors an Thrombozyten
- verminderte Thrombozytenadhäsion
- Typ 2N:
- qualitativer Defekt mit verminderter Bindung des Von-Willebrand-Faktors an Faktor VIII:C, dadurch reduzierte Faktor-VIII-Spiegel infolge gesteigerten proteolytischen Abbaus
- autosomal-rezessiv vererbt
- Typ 3 (weniger als 5% der Fälle):
- seltene, aber schwerste Verlaufsform
- homozygote oder Compound-heterozygote Mutation des Von-Willebrand-Faktor-Gens, dadurch fehlender Von-Willebrand-Faktor und stark verminderte Faktor-VIII-Spiegel (nur bis 10% der Norm)
- in der Folge hohes Blutungsrisiko für Mutter und Kind
- Typ 1 (54–80%):
- Blutungsneigung in der Schwangerschaft: abhängig vom Typ bzw. Subtyp:
- Typ 1:
- in 90% dieser Fälle Faktorenspiegel am Termin bei milden Formen im Normbereich oder sogar darüber
- in diesen Fällen kein erhöhtes Blutungsrisiko, kein Einfluss auf Regionalanästhesie bzw. Geburt
- Typ 2:
- Anstieg des Von-Willebrand-Faktor-Antigen-Spiegels in der Schwangerschaft
- infolge der Bildung von abnormen Von-Willebrand-Faktor-Multimeren aber nur minimaler oder gar kein Anstieg der Von-Willebrand-Faktor-Aktivität, deshalb erhöhtes Risiko für Blutungen
- Typ 2A:
- Anstieg der Spiegel des Von-Willebrand-Faktor-Antigens und des Faktors VIII in der Schwangerschaft, aber Von-Willebrand-Faktor-Aktivität signifikant vermindert
- gilt auch für Typ 2M
- Typ 2B:
- Diagnose häufig erst in der Schwangerschaft oder peripartal über die Labordiagnose einer Thrombozytopenie (häufig auch „Riesenthrombozyten“), die durch spontane Thrombozytenaggregation infolge einer erhöhten Produktion abnormer intermediärer Multimere verursacht wird
- Nadir der Thrombozytopenie im 3. Trimenon korrespondierend zum Peak des Von-Willebrand-Faktor-Spiegels
- bei diesem Typ Assoziation mit schweren Thrombozytopenien und einer weiteren Erhöhung des Blutungsrisikos in der Schwangerschaft möglich
- Typ 2N:
- kein Anstieg der Faktor-VIII-Spiegel im Verlauf der Schwangerschaft
- erhöhtes Blutungsrisiko
- Typ 3:
- kein Anstieg des Von-Willebrand-Faktor-Spiegels in der Schwangerschaft infolge fehlender endothelialer Von-Willebrand-Faktor-Speicher, nur geringer Anstieg des Faktor VIII
- deswegen Risiko für schwere Blutungskomplikationen in der Schwangerschaft, bei der Geburt und post partum
- Typ 1:
|
Initiale Behandlung bei Faktor-VIII- oder Von-Willebrand-Faktor-Aktivität < 0,50 IU/ml |
||||
|
Desmopressin, Faktorenkonzentrat |
||||
|
|
Verlust hochmolekularer Multimere; verminderte Von-Willebrand-Faktor-abhängige Thrombozytenadhäsion |
Desmopressin, Faktorenkonzentrat |
||
|
|
Fehlen großer Von-Willebrand-Faktor-Multimere; vermehrte Bindung des Von-Willebrand-Faktors an Thrombozyten; Thrombozytopenie |
Faktorenkonzentrat, kein Desmopressin |
||
|
|
Multimerisierungsdefekt (verminderte Bindung des Von-Willebrand-Faktors an Thrombozyten) |
Desmopressin, Faktorenkonzentrat |
||
|
|
verminderte Bindung des Von-Willebrand-Faktors an Faktor VIII |
Desmopressin, Faktorenkonzentrat |
||
Symptomatik
- Breites Spektrum an gynäkologischen Symptomen in Abhängigkeit vom zugrundeliegenden Defekt und dessen Ausprägung:
- rezidivierendes Nasenbluten: mehr als 60%
- Hypermenorrhö: 74–100%
- Menorrhagien: ca. 60% (vor allem bei Typ 3 100%) und ⅔ der Fälle mit Typ 1
- Nachblutungen nach Bagatelltraumata wie z.B. Zahnextraktionen: ca. 50%
- Neigung zu Ausbildung von Hämatomen („blaue“ Flecken): ca. 50%
- Gingivablutungen: 35%
- Blutungen bei oder nach Operationen: ca. 30%
- spontane Gelenkblutungen oder Muskeleinblutungen sowie gastrointestinale Blutungen (vor allem Typ 3, seltener Typ 2): selten
| Merke Die Prävalenz des Von-Willebrand-Syndroms bei Frauen mit Menorrhagie liegt bei 5–24% (bis zu 13% aller nicht diagnostizierten Von-Willebrand-Fälle). |
| Cave Infolge von schweren Blutungen mit sekundärer Anämie besteht bei Von-Willebrand-Syndrom ein erhöhtes Risiko für eine Hysterektomie (Typ 2 und 3: 23%, Typ 1: 8–18%). |
Diagnostik
Diagnostisches Vorgehen
-
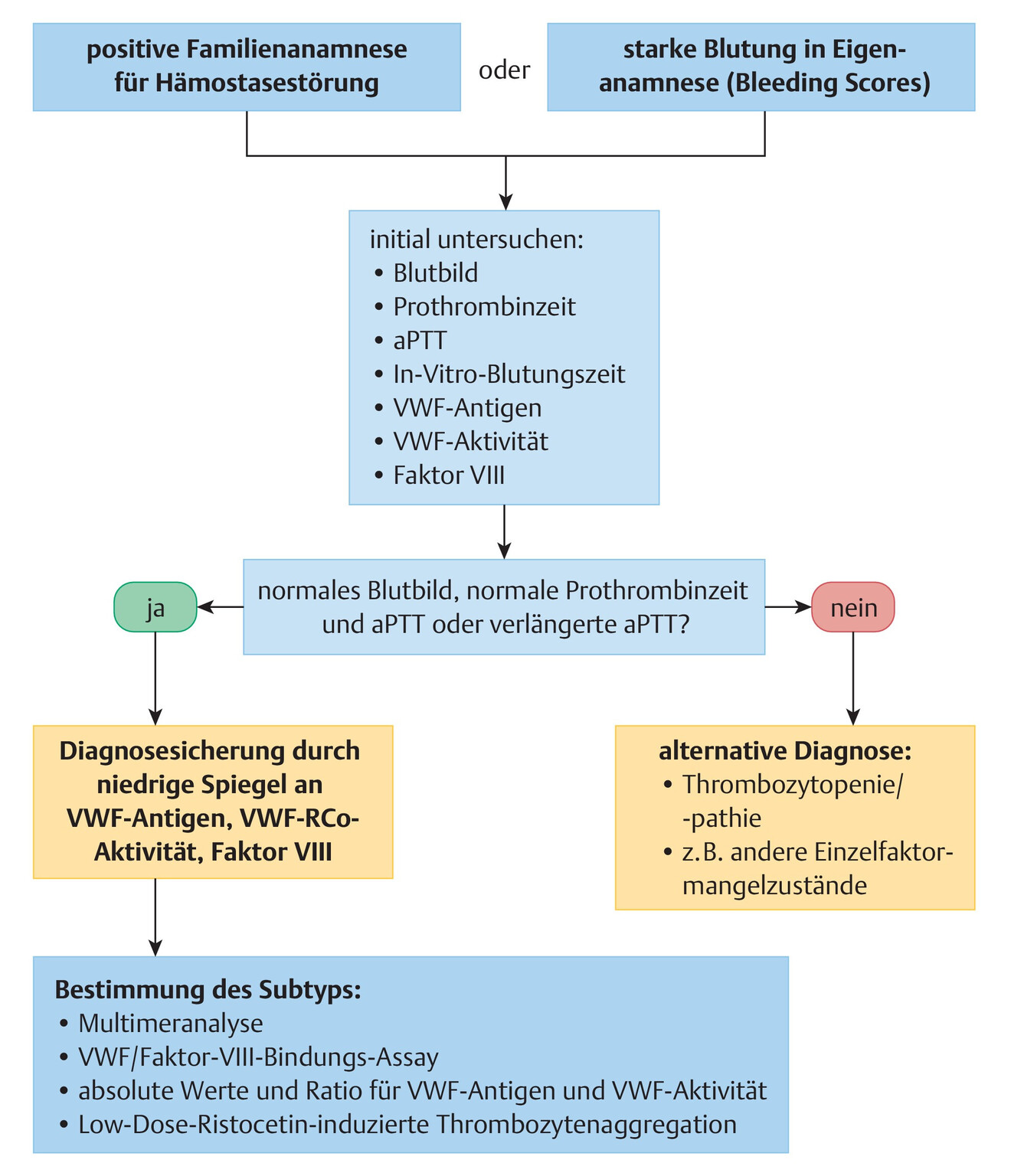
Bei Verdacht auf eine verstärkte Blutungsneigung besteht das Stufenkonzept zur Diagnosestellung aus der Erhebung der Familienanamnese und der Blutungsanamnese der Patientin sowie einer orientierenden und erweiterten Labordiagnostik (Abb. 12.9).
Abb. 12.9 Diagnostischer Algorithmus bei Von-Willebrand-Syndrom.
(modifiziert nach Quelle: Reynen E, James P. Von Willebrand disease and pregnancy: a review of evidence and expert opinion. Semin Thromb Hemost 2016; 42 (7): 717–723)
aPTT = aktivierte partielle Thromboplastinzeit
VWF = Von-Willebrand-Faktor
Anamnese
- Familienanamnese: falls angeborene Gerinnungsstörung in der Familie bekannt, möglichst schon präkonzeptionelle Beratung, Vererbungsmodus
- Eigenanamnese, vor allem Blutungsanamnese: mit folgenden Kriterien (internationales Expertengremium) [3]:
- Menorrhagie seit Menarche
- Nasenbluten über mehr als 10 min, Gingivablutungen
- kleinflächige Hautblutungen ohne Trauma
- Blutungen aus kleinen Wunden
- verlängerte Blutungen nach Zahnextraktionen oder postoperativ
- Blutungen mit Notwendigkeit zur Bluttransfusion (um das 5-Fache erhöht)
- postpartale Blutung
- gastrointestinale Blutungen
- positive Familienanamnese für Hämostasestörung
| Cave Das Fehlen einer positiven Familienanamnese schließt ein Von-Willebrand-Syndrom nicht aus (z.B. variable Penetranz bei Typ 1). |
| Praxistipp Durch einen gezielten Fragenkatalog zur Blutungsanamnese mit oder ohne Erhebung eines Bleeding Score können Frauen mit Hämostasestörungen und insbesondere mit Von-Willebrand-Syndrom frühzeitig identifiziert werden (z.B. Score der International Society on Thrombosis and Haemostasis). Die Blutungs-Scores korrelieren mit dem Schweregrad des Von-Willebrand-Syndroms (Typ 3: höchste Blutungs-Scores, Typ 1: niedrigste Blutungs-Scores). |
Körperliche Untersuchung
-
Ganzkörperliche Inspektion auf u.a. Ekchymosen, Einblutung in Gelenke bzw. Muskulatur, Hinweise auf vorangegangenes Nasenbluten
Labor
- Orientierende Diagnostik bei entsprechender Anamnese:
- Blutbild mit Thrombozyten, Prothrombinzeit, aktivierter partieller Thromboplastinzeit, evtl. In-Vitro-Blutungszeit (Platelet Function Analyzer; Übersichten bei [3], [7])
- in Vivo ermittelte Blutungszeit bei einer Sensitivität von nur 50% nicht mehr empfohlen
- Blutbild und globale Gerinnungstests beim Von-Willebrand-Syndrom meist im Normbereich; Verlängerung der aktivierten partiellen Thromboplastinzeit bei schweren Formen mit deutlicher Faktor-VIII-Defizienz möglich
- erweiterte Diagnostik:
- Von-Willebrand-Faktor-Antigen im Plasma (ELISA): quantitativer Test mit Bestimmung der absoluten Menge des Von-Willebrand-Faktors; kein Funktionstest
- Von-Willebrand-Faktor-Aktivität: funktioneller, qualitativer Test zur Bestimmung der Funktionsfähigkeit des Von-Willebrand-Faktors zur Thrombozytenaggregation oder Verwendung von Fragmenten des rekombinanten Glykoproteins Ib (z.B. Von-Willebrand-Faktor: G1bM)
- Faktor-VIII-Aktivität: Anteil des Faktor-VIII-Mangels am Blutungsphänotyp (vor allem bei Typ 3, Typ 2N)
- spezielle Diagnostik:
- Analyse der Von-Willebrand-Faktor-Multimere
- Faktor-VIII-Bindungskapazität des Von-Willebrand-Faktors
- vermehrte ristocetininduzierte Thrombozytenaggregation bei Typ 2B
- Von-Willebrand-Faktor-Kollagen-Bindungsaktivität
- Von-Willebrand-Faktor-Propeptid
- infolge der Komplexität der Befundkonstellationen Diagnostik möglichst in enger Zusammenarbeit mit einem erfahrenen Hämostaseologen und einem spezialisierten Labor
- Laborkontrollen in Schwangerschaft und Wochenbett:
- Konzentration des Von-Willebrand-Faktor-Antigens, Von-Willebrand-Faktor-Aktivität, Faktor-VIII-Aktivität
- vor jedem invasiven Eingriff, z.B. Amniozentese, CVS, Zerklage
- mindestens einmal pro Trimenon
- innerhalb von 2 Wochen vor der Geburt
- bis zu 2 Wochen post partum, ggf. auch länger bis zum Abschluss des Wochenbetts
- HINWEIS : die Schwangere sollte sich im 3. Trimenon zur Planung des Anästhesieverfahrens und der Geburt in der Entbindungsklinik vorstellen.
- molekulargenetische Diagnostik:
- in der Regel nicht durchgeführt
- ggf. in Zusammenarbeit zwischen Humangenetik und spezialisiertem Hämostaseologen Beratung anbieten
- pränatale Diagnostik durch CVS oder Amniozentese: möglich
Differenzialdiagnosen
- Mögliche Differenzialdiagnosen s. in Tab. 12.23
|
Blutungsneigung bei Faktor-VIII-Mangel (meist Konduktorinnen bei X-chromosomalem Erbgang), verlängerte aPTT, aber normale Von-Willebrand-Faktor-Parameter, insbesondere differenzialdiagnostische Abgrenzung zu Typ 2N des Von-Willebrand-Syndroms (genetische Beratung) |
|
|
Blutungsneigung bei Faktor-IX-Mangel (meist Konduktorinnen bei X-chromosomalem Erbgang), Verminderung des Quickwerts (selten!) |
|
|
|
z.B. Bernard-Soulier-Syndrom, Platelet-Type (Pseudo-)Von-Willebrand-Syndrom |
Therapie
Therapeutisches Vorgehen
-
Siehe dazu Tab. 12.22.
Allgemeine Maßnahmen
-
Schwangere mit Von-Willebrand-Syndrom sollten sich des erhöhten Blutungsrisikos bewusst sein und möglichst Traumata vermeiden. Notwendig ist außerdem eine ausführliche Beratung der Schwangeren über das erhöhte Blutungsrisiko, besonders bei Typ 1, wenn die Von-Willebrand-Faktor-Spiegel am Termin nicht über 50 IU/dl steigen, sowie bei Typ 2 und 3.
-
Invasive Maßnahmen sowie die Planung der Geburt sollten unter Berücksichtigung der spezifischen Diagnostik in Zusammenarbeit mit einem erfahrenen Hämostaseologen erfolgen.
Geburtshilfliches Management
- Übersicht: bei [1], [2]
- Regionalanästhesie:
- erhöhtes Risiko für Hämatombildung (Spinalhämatom)
- vor Regionalanästhesie Von-Willebrand-Faktor/Faktor-VIII-Bestimmung; bei Typ 1 und Faktorenspiegel über 50 IU/ml Regionalanästhesie im Allgemeinen problemlos möglich
- Die Leitlinien der ASH ISTH NHF WFH propagieren einen Faktorenspiegel von 50-150 IU/dl , während der Regionalanästhesie und für mindestens 6 Stunden nach Entfernung des Katheters
- sollte der Faktorenspiegel über 50 IU/dl gehalten werden ( niedrige Evidenz, 8 ) ; darunter bisher keine Spinalhämatome publiziert
- keine Regionalanästhesie bei Typ 2B und 2N (nur, wenn Von-Willebrand-Faktor- bzw. Faktor-VIII-Spiegel über 50 IU/dl)
- bei Typ 3 evtl. Regionalanästhesie nach Gabe von Faktorenkonzentraten und bei normalen Faktorenspiegeln
- keine Gabe von die Thrombozytenfunktion beeinträchtigenden Medikamenten wie ASS oder NSAID (z.B. Ibuprofen)
- keine intramuskulären Injektionen
- vor Geburt Verfügbarkeit von Desmopressin bzw. Faktorenkonzentraten prüfen; Labordiagnostik
- vor der Geburt Gabe von 1 g Tranexamsäure langsam i.v. vor allem bei Typ 2 und 3 sowie schwerem Typ 1 [3]
- keine äußere Wendung, keine Skalpelektrode, keine fetale Blutgasanalyse
- Vakuumextraktion kontraindiziert, Forzepsentbindung nur bei strenger Indikationsstellung, nur Beckenausgangsforzeps durch erfahrenen Geburtshelfer
- erhöhtes Risiko für intrakranielle Blutungen und Skalphämatome beim Kind
- Vermeidung einer protrahierten Austreibungsperiode
- aktive Leitung der Nachgeburtsperiode:
- leitlinien-konforme Oxytocin Applikation
- erhöhtes Risiko für postpartale Blutung, deshalb Messung des Blutverlusts
- bisher keine Hinweise dafür vorhanden, dass aufgrund einer etwaigen Blutungsgefährdung des Feten bzw. Neugeborenen die Sectio caesarea Vorteile im Vergleich zur vaginalen Entbindung bietet; daher Sektio nur aus geburtshilflicher Indikation
- bei Typ 2B an Thrombozytopenie denken, deshalb Thrombozytenkontrolle (mikroskopische Auswertung!)
- sorgfältige Blutstillung bei Episiotomie, geburtshilflichen Verletzungen und Sectio caesarea (ggf. intraabdominelle Drainage), da erhöhtes Risiko für Nachblutungen und Hämatombildung; prophylaktische Gabe von Desmopressin bzw. Faktorenkonzentraten erwägen, abhängig von Blutung und Faktorenspiegeln
- post partum:
- erhöhtes Risiko für primäre und sekundäre postpartale Blutungen
- rascher, progredienter Abfall der Von-Willebrand-Faktor/Faktor-VIII-Spiegel innerhalb von 24–48 h nach der Geburt, Abfall auf präpartale Spiegel innerhalb von 3 Wochen
- nach der Geburt Von-Willebrand-Faktor-Aktivität und Faktor-VIII-Spiegel für mindestens 5 Tage nach unkomplizierter vaginaler Geburt und für mindestens 7 Tage nach Sektio (vaginal-operative Entbindung) bei über 50 IU/dl halten, um postpartale Blutungen zu vermeiden; deshalb engmaschige Kontrolle der Faktorenspiegel auch bei Normalwerten während der Schwangerschaft, ggf. prophylaktische Gabe von Desmopressin oder Faktorenkonzentraten [6]
- Gabe von initial 1 g Tranexamsäure intravenös nach Abklemmen der Nabelschnur als Prophylaxe zur Vermeidung postpartaler Blutungen [8] Durch die postpartale Gabe von Tranexamsäure wird vor mallem das Risiko für sekundäre postpartale Blutungen signifikant gesenkt und die Notwendigkeit von Bluttransfusionen [9]
- Gabe von niedermolekularem Heparin zur Thromboembolieprophylaxe bei stationären Patientinnen mit adäquater Korrektur der Von-Willebrand-Faktor-Aktivität bzw. der Von-Willebrand-Faktor-Antigen-Konzentration und des Faktor-VIII-Spiegels, kein Heparin bei Spiegeln unter 50 IU/dl [6]
- Hinweis auf sekundäre postpartale Blutung noch 2 – 20 Tage nach der Geburt(11) :Information an Patientin und Hebamme, Telefonkontakt
- bei Typ 3 häufig Therapie mit Von-Willebrand-Faktor-Konzentraten noch 2–3 Wochen oder länger nach der Geburt erforderlich [6]
- Kind:
- s. dazu [3], [6]
- diagnostischer Behandlungsplan nach der Geburt des Kindes: Entnahme von Nabelschnurblut zur Bestimmung der Von-Willebrand-Faktor-Aktivität, des Von-Willebrand-Faktor-Antigens sowie des Faktors VIII bei Kindern mit Risiko für schweren Typ 2 und 3
- gründliche körperliche Untersuchung des Neugeborenen auf Blutungen
- transkranielle Ultraschalluntersuchung, insbesondere bei Typ 3, da erhöhtes Risiko für intrakranielle Blutungen
- bis der Laborstatus bekannt ist, keine i.m. Injektionen, orale Gabe von Vitamin K
- evtl. Konsultation mit einem spezialisierten Hämostaseologen
- Diagnose eines leichten Von-Willebrand-Syndroms oft schwierig, da bei normalen Neugeborenen Von-Willebrand-Faktor-Antigen-Konzentration und -Aktivität bei Geburt erhöht; dadurch Maskierung einer Defizienz in der Neonatalperiode; diese aber ohne Relevanz für diese Zeit, Kontrolle vor Eingriffen im Kleinkindalter aber erforderlich
| Merke Das Von-Willebrand-Syndrom ist per se keine Indikation zur Sektio! Es bestehen keine signifikanten Unterschiede hinsichtlich der Rate intrakranieller Blutungen beim Kind zwischen vaginaler Geburt ( 2,4%) und Entbindung durch Sektio /1,7%) Im Vergleich zur vaginalen Entbindung ist die vaginal – .operative Entbindung mit einer 4,8-Fach Rate an intrakraniellen Blutungen assoziiert. (etwa 10%) [10 |
Pharmakotherapie
- Diesbezügliche Empfehlungen basieren auf Expertenmeinung (Grad C).
- Die Therapie hat sich vor allem am Typ des Von-Willebrand-Syndroms, am klinischen Schweregrad und am zu erwartenden Blutungsrisiko zu orientieren.
| Praxistipp Bei Schwangeren ohne relevante Blutungen in der Anamnese sowie Typ 1 und Von-Willebrand-Faktor-Aktivität/Antigen/Faktor-VIII-Spiegel über 50 IU/dl zum Zeitpunkt der Geburt ist im Allgemeinen keine spezielle Therapie erforderlich [3]. Die holländische Leitlinie propagiert einen Cut-off Wert von 80-100 IU/dl zur Vermeidung postpartaler Blutungen ( 10) Schwangere mit Typ 2 und 3 sowie mit Typ 1 und Faktorenspiegel unter 50 IU/dl sollten in einem Perinatalzentrum in Kooperation mit einem spezialisierten Hämostaseologen entbunden werden. |
Desmopressin
- Eigenschaften:
- synthetisches Analogon des antidiuretischen Hormons Vasopressin
- Freisetzung des Von-Willebrand-Faktors bzw. des Faktors VIII aus endothelialen Speichern
- Dosierung (z.B. Minirin):
- i.v. 0,2–0,3 µg/kg Körpergewicht vor der Schwangerschaft, verdünnt in 50–100 ml 0,9%iger Kochsalzlösung als Kurzinfusion über 30 min; Applikation ca. 30–60 min vor geplantem Eingriff bzw. möglichst nah vor der Geburt (Beginn regelmäßiger, geburtauslösender Wehen)
- bei Geburt i.v. Gabe nach Abklemmen der Nabelschnur zur Vermeidung schwerer Hypotonien
- Gabe 3–5 Tage post partum, aber nur maximal 3-mal die Gabe fortsetzen; Faktorenspiegel über 50 IU/dl halten
- Wirkung:
- Erhöhung des Von-Willebrand-Faktor/Faktor-VIII-Spiegels um das 3- bis 5-Fache über Normalbereich (normale Plasmakonzentration ca. 10 µg/ml) innerhalb von 30–60 min, Wirkungsbeginn nach 15 min, Wirkungsdauer 6–8 h; Zielspiegel für Von-Willebrand-Faktor-Aktivität ca. 100 IU/dl
- kein diaplazentarer Übergang auf den Feten
- bei wiederholter Gabe Tachyphylaxie und Wirkverlust innerhalb der nächsten 12 h infolge Entleerung der Von-Willebrand-Faktor/Faktor-VIII-Speicher
- nicht geeignet bei Schwangeren mit Basisspiegeln des Von-Willebrand-Faktors oder des Faktors VIII unter 15 IU/dl
- Kontraindikationen:
- Typ 2B
- Präeklampsie
- Angina Pectoris
- Herzinsuffizienz
- unkontrollierte Hypertonie
- Epilepsie
- Nebenwirkungen:
- Flush
- Kopfschmerzen
- leichte Tachykardie
- Hypotonie (Blutdruckkontrollen erforderlich!)
- aufgrund des antidiuretischen Effekts Flüssigkeitsrestriktion und Hyponatriämie, daher Bilanzierung über mindestens 24 h nach Gabe, Elektrolytkontrolle, Flüssigkeitsrestriktion auf 1 l für 24 h
- partielle Bindung an den Oxytocinrezeptor, dadurch Auslösung uteriner Kontraktionen möglich
- Indikationen (vgl. Tab. 12.22) [3], [7]:
- bei Typ 1: bei Faktor-VIII- und/oder Von-Willebrand-Faktor-Spiegeln unter 50 IU/dl vor bzw. zum Zeitpunkt der Geburt Response-Rate ca. 90%
- bei Typ 2: deutlich geringere Wirkung als bei Typ 1 (qualitativer Defekt); Response-Rate 54%
- bei Typ 2B: kontraindiziert, da eine bestehende Thrombozytopenie noch verstärkt werden kann.
- bei Typ 2N: Response-Rate 39%; verkürzte Ansprechbarkeit auf Desmopressin
- bei Typ 3: nicht indiziert, da keine Wirkung; stattdessen Gabe von Faktorenkonzentraten
- bei schwerer primärer postpartaler Blutung in der Anamnese: Gabe von Desmopressin peripartal und ggf. 24 h später Wiederholung
- bei Schwangeren mit bekanntem Von-Willebrand-Syndrom: sowohl Desmopressin als auch Faktorenkonzentrate prophylaktisch zur Behandlung postpartaler Blutungen bereithalten
| Praxistipp Der sog. Desmopressintest sollte bei Von-Willebrand-Syndrom vor der Schwangerschaft nach Ausschluss eines Typs 2B und 3 zur Prüfung der klinischen Ansprechbarkeit auf Desmopressin durchgeführt werden (nicht in einer Schwangerschaft): Nach Gabe von 0,2–0,3 µg/kg Körpergewicht Desmopressin i.v. steigt innerhalb von 1 h der Von-Willebrand-Faktor/Faktor-VIII-Plasmaspiegel auf Maximalwerte an und fällt dann über 4–8 h ab. Die Messung der Faktorenspiegel sollte unmittelbar vor Infusion, nach 30 min und 1 und 2 h nach Infusionsende erfolgen. Bei Nichtansprechen auf Desmopressin sind Faktorenkonzentrate notwendig. |
Antifibrinolytika (Tranexamsäure)
- Tranexamsäureheute Bestandteil des Behandlungskonzepts der primären postpartalen Blutung
- bei Von-Willebrand-Syndrom [4]:
- 1 g Tranexamsäure i.v. in Kombination mit Desmopressintherapie vor der Geburt bei Typ 2 und Typ 3 sowie bei schwerer Form von Typ 1 ohne Normalisierung der Faktorenspiegel im 3. Trimenon; Tranexamsäure allein ausreichend bei Schwangeren mit Von-Willebrand-Faktor-Aktivität über 50 IU/dl
- orale Gabe von Tranexamsäure post partum: 1 g oral 3× täglich über 10 – 14 Tage, dadurch signifikante Senkung der Rate an sekundären postpartalen Blutungen [6,8]
| Merke Tranexamsäure geht nur zu 1% in die Muttermilch über! |
Plasmatische Von-Willebrand-Faktor/Faktor-VIII-Konzentrate
- Eigenschaften:
- hoher Anteil an hochmolekularen Von-Willebrand-Faktoren
- i.v. Infusion
- Indikationen:
- bei Kontraindikation für Desmopressin oder bei fehlendem Ansprechen auf Desmopressin bei Von-Willebrand-Faktor/Faktor-VIII-Spiegeln unter 50 IU/dl im 3. Trimenon bzw. vor der Geburt
- bei Typ 2, insbesondere bei Typ 2B First-Line-Therapie
- bei Typ 3
- Dosierung:
- abhängig vom klinischen Schweregrad und Typ des Von-Willebrand-Syndroms
- unterschiedliche Dosierungsempfehlungen (Empfehlungsgrad C):
- Übersichten bei [1], [5]
- 30–40(–50) IE/kg Körpergewicht als Initialdosis, dann 15–25 IE/kg Körpergewicht alle 12 h über 3–5 Tage
- bei schwerem Von-Willebrand-Syndrom und Von-Willebrand-Faktor-Spiegel unter 10 IU/dl und/oder Faktor-VIII-Spiegel unter 20 IU/dl (Typ 3 und mehrheitlich Typ 2): 40–60 IE/kg Körpergewicht bei Wehenbeginn, dann 2× täglich 25 IE/kg Körpergewicht über 3–5 Tage nach vaginaler Geburt und über 5–7 Tage nach Sectio caesarea, abhängig von Blutung und Faktorenspiegeln; engmaschige Kontrolle der Faktorenspiegel
- nach dem Australian Consensus Statement 2019 Applikation von Faktorenkonzentraten bei Typ 1 und 2 0–4 h und bei Typ 3 0–2 h vor der Geburt bzw. dem Anlegen einer Spinalanästhesie [2]
- Nebenwirkungen:
- Entwicklung von Hemmkörpern, Wirkverlust
- allergische Reaktionen
- kein signifikant erhöhtes Thromboembolie – Risiko
Rekombinante Von-Willebrand-Faktoren-Konzentrate
- Zugelassen
- gleich effektiv wie plasmatische Faktorenkonzentrate, aber 1,4-fach längere Halbwertszeit
- bisher keine (ausreichenden) Erfahrungen in Schwangerschaft und Wochenbett
Verlauf und Prognose
- Übersicht bei [7]
- keine Einschränkung der Fertilität
- Spontanabortrate: verstärkte Blutungen nach spontanen und induzierten Aborten (besonders Typ 3)
- erhöhtes Risiko für antepartale Blutungen (bis zu 10-fach): besonders bei Typ 3, allerdings limitierte Datenlage
- kein erhöhtes Risiko für vorzeitige Plazentalösung, IUGR, Frühgeburt und intrauterinen Fruchttod
- kein erhöhtes Risiko für thromboembolische Komplikationen
- im Allgemeinen kein erhöhtes Blutungsrisiko unter der Geburt bei asymptomatischen Schwangeren mit Von-Willebrand-Faktor-Spiegeln über 50 IU/dl
- erhöhtes Risiko für perineale Hämatome
- – 1,5-3 -Fach erhöhtes Risiko für primäre postpartale Blutung (20-50%), deshalb Notwendigkeit zu Bluttransfusionen um das 5-Fache erhöht, kein signifikant erhöhtes Risiko bei Typ 1 [12] , auch unter adäquater Faktorengabe postpartale Blutungen in bis zu 25% möglich
- erhöhtes Risiko für sekundäre postpartale Blutung (11–33 ), auch bei Typ 1% [12]
- erhöhte mütterliche Letalität (123:100 000 versus 12,7:100 000 Geburten [7])
Literatur
Quellenangaben
-
[1] Castaman G, James PD. Pregnancy and delivery in women with von Willebrand disease. Eur J Haematol 2019; 103: 73–79
Suche in: PubMed Google Scholar -
[2] Dunkley S, Curtin JA, Marren AJ. Updates Australian consensus statement on management of inherites bleeding disorders in pregnancy. MJA 2019; 210: 326–332
Suche in: PubMed Google Scholar -
[3] James AH, Eikenboom J, Federici AB. State of the art: von Willebrand disease. Haemophilia 22; 2016 (Suppl. 5): 54–59
Suche in: PubMed Google Scholar -
[4] Kouides PA. Antifibrinolytic therapy for preventing vWS-related postpartum haemorrhage: indications and limitations. Blood Adv 2017; 1: 699–702
Suche in: PubMed Google Scholar -
[5] Leebeek FWG, Atig F. How I manage severe von Willebrand disease. Br J Haematol 2019; 187: 418–430
Suche in: PubMed Google Scholar -
[6] Pavord SR, Rayman R, Medan B et al. Management of inherited bleeding disorders in pregnancy. RCOG Green-Top Guideline No. 71. BJOG 2017; 124: e193-e263
Suche in: PubMed Google Scholar -
[7] Reynen E, James P. Von Willebrand disease and pregnancy: a review of evidence and expert opinion. Semin Thromb Hemost 2016; 42 (7): 717–723
Suche in: PubMed Google Scholar -
[8] Connell NT, Flood VH, Brignardello- Petersen R et al; ASH ISTH NHF WFH 2021 guidelines on the management of von Willebrand disease Blood Adv 2021, 5: 301-325
Suche in: PubMed Google Scholar -
[9] Brignardello-Petersen R, El Alayli A, Husainat N et al Gynecologic and obstetric management of women with von Willebrand disease: summary of 3 systematic reviews of the literature Blood Adv, 2022, 6: 228-237
Suche in: PubMed Google Scholar -
[10] Leebeck FWK, Duvekot J, Kruip M; How I manage pregnancy in carriers of hemophilia and patients with von Willebrand disease Blood 2020, 136: 2143-2150
Suche in: PubMed Google Scholar -
[11] Andersson NG, Chalmers E A, Kenet G et al; Mode of delivery in hemophilia : vaginal delivery and cearean saection carry similar risks for intracranial hemorrhage and other major bleeds Hematologica 2019, 104: 2100-2106
Suche in: PubMed Google Scholar -
[12] Pierce-Williams RAM, Makhamreh MM, Blakey-Cheung S, Gao Z: Postpartum hemorrhage in patients with Type 1 von willebrand disease: a systematic review Semin Thromb Hemost 2022, 48: 219-228
Suche in: PubMed Google Scholar
Literatur zur weiteren Vertiefung
-
[13] Ragni MV. Blood volume-bases von Willebrand factor to prevent postpartum haemorrhage in von Willebrand disease. Blood Advances 2017; 1: 703–706
Suche in: PubMed Google Scholar -
[14] Janbain M, Kouides P Managing pregnant women with hemophilia and von willebrand disease: How do we provide optimum care and prevent complications? Int J Women´s Health 2022, 14 1307-1313
Suche in: PubMed Google Scholar -
[15] Pacheco LD, Saade GR, James AH Von Willebrand disease, hemophilia, and other inherited bleeding disorders in pregnancy Obstet Gynecol 2023, 141:493-504
Suche in: PubMed Google Scholar -
[16] James Ah, Pacheco LD, Konkle BA Management of pregnant women who have bleeding disorders Hematology 2023, 229-235
Suche in: PubMed Google Scholar -
[17] Sadler B, Castaman G, O`Donnell JS: Von Wllebrand disease and von Willebrand Factor Haemophilia 2022, 28 ( Suppl,4) 11-17
Suche in: PubMed Google Scholar
Wichtige Internetadressen
-
International Society on Thrombosis and Haemostasis: Bleeding Scores: https://www.isth.org/page/reference_tools